Primeiro dois conceitos, a partir da trivial Wikipédia em inglês, com algumas edições e revisão.
1
Ebulição explosiva
Em termodinâmica, a ebulição explosiva ou explosão de fase é um processo pelo qual um líquido metaestável superaquecido sofre uma transição de fase líquido-vapor explosiva para um estado de duas fases estável devido a uma maciça nucleação homogênea de bolhas de vapor. Este conceito foi iniciado por M. M. Martynyuk em 1976,[1] e então posteriormente aperfeiçoado por Fucke e Seydel.[2]
Mecanismo
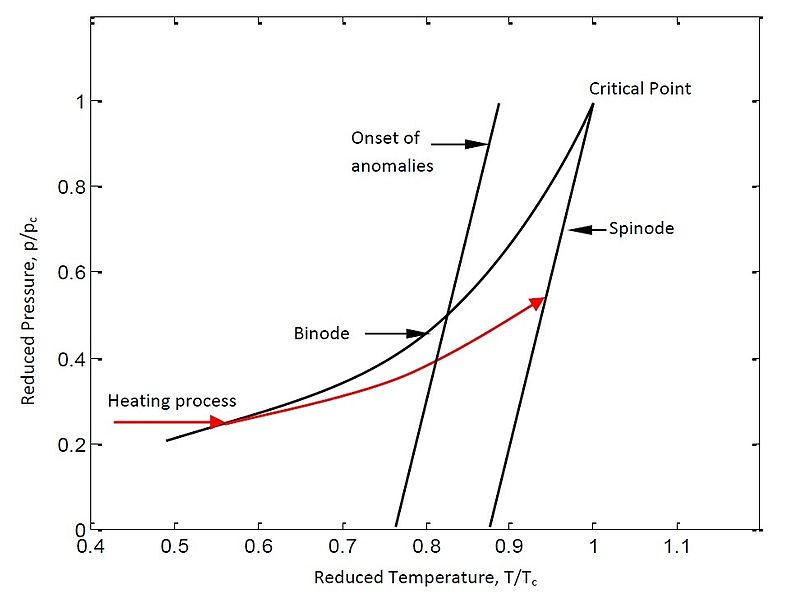
Esta figura mostra o binodal e spinodal e a curva vermelha mostra um ciclo de aquecimento típico, isto mostra o conceito de ebulição explosiva.
A ebulição explosiva pode ser melhor descrita por um diagrama de fase p-T.[3] A figura acima mostra um diagrama de fase p-T típico de uma substância. A linha binodal ou a curva de coexistência é um estado termodinâmico onde a essa temperatura e pressão específicas, o líquido e o vapor podem coexistir. A linha espinodal à direita é o limite da instabilidade absoluta de uma solução para a decomposição em múltiplas fases. Um processo de aquecimento típico é mostrado usando cor vermelha.
Se o processo de aquecimento é relativamente lento, o líquido tem tempo suficiente para relaxar até um estado de equilíbrio e o líquido segue a curva binodal, a relação Clausius-Clapeyron ainda é válida. Durante este tempo a evaporação heterogênea ocorre na substância com as bolhas que nucleiam dos locais de impurezas, das superfícies, dos limites do grão etc.[4]
Esta figura mostra a alteração das propriedades termodinâmicas próximas ao ponto crítico.
Por outro lado, se o processo de aquecimento é suficientemente rápido para que a substância não possa atingir a curva binodal através de uma ebulição heterogénea, o líquido torna-se superaquecido com a sua temperatura acima do ponto de ebulição a uma determinada pressão. O sistema então desloca-se para longe do binodal e continua a seguir a curva vermelha e aproxima-se assim para o spinodal. Perto das propriedades termodinâmicas da temperatura crítica, como o calor específico, a densidade varia rapidamente como mostrado na figura à direita. A densidade e a entropia sofrem maior flutuação. Durante este tempo é possível ter uma grande flutuação de densidade em um volume muito pequeno. Esta flutuação da densidade resulta na nucleação de uma bolha. O processo de nucleação de bolhas ocorre homogeneamente em toda parte da substância. A taxa de nucleação de bolhas e taxa de crescimento da esfera de vapor aumenta exponencialmente mais perto da temperatura crítica. A nucleação crescente impede que o sistema vá para o spinodal. Quando o raio da bolha atinge o tamanho crítico, continua a expandir-se e, eventualmente, explode resultando uma mistura de gás e gotículas que é designada como explosão de ebulição ou explosão de fase.
No início, a ebulição explosiva foi usada por Martynyuk para calcular a temperatura crítica dos metais. Usou a resistência elétrica para aquecer o fio de metal. Verificou-se que a ebulição explosiva posterior ocorreu ao utilizar ablação a laser ultra-rápida de femtosegundo, embora este tipo de explosão de ebulição deva ocorrer por qualquer mecanismo pelo qual a temperatura do líquido é rapidamente aumentada perto da temperatura crítica da substância.
Referências
1.Martynyuk, M. M. (1 March 1977). "Phase explosion of a metastable fluid". Combustion, Explosion, and Shock Waves. 13 (2): 178–191. doi:10.1007/BF00754998.
2.Seydel, U; Fucke, W (1 July 1978). "Experimental determination of critical data of liquid molybdenum". Journal of Physics F: Metal Physics. 8 (7): L157–L161. Bibcode:1978JPhF....8L.157S. doi:10.1088/0305-4608/8/7/003.
3.Bulgakova, N.M.; Bulgakov, A.V. (1 August 2001). "Pulsed laser ablation of solids: transition from normal vaporization to phase explosion". Applied Physics A: Materials Science & Processing. 73 (2): 199–208. doi:10.1007/s003390000686.
4.Christensen, B.; MS Tillack (2003). "Survey of mechanisms for liquid droplet ejection from surfaces exposed to rapid pulsed heating" (PDF). University of California, UCSDENG-100.
2
Explosão do vapor expandido por líquido em ebulição (BLEVE)
Explosão do vapor expandido por líquido em ebulição, citada também como explosão do vapor de expansão de um líquido sob pressão (BLEVE, boiling liquid expanding vapor explosion) é uma explosão causada pela ruptura de um recipiente contendo líquido apressurizado acima do seu ponto de ebulição.[1]
Mecanismo
Existem três características dos líquidos que são relevantes para a discussão de uma BLEVE:
1.Se um líquido em um recipiente selado é ebulido, a pressão dentro do recipiente aumenta. Como o líquido muda para um gás que se expande ― esta expansão em um recipiente ventilado faria com que o gás e o líquido ocupassem mais espaço. Em um recipiente fechado o gás e o líquido não são capazes de ocupar mais espaço e, portanto, a pressão sobe. Os recipientes pressurizados que contêm líquidos podem atingir um equilíbrio onde o líquido pára de ferver e a pressão pára de subir. Isso ocorre quando calor não mais está sendo adicionado ao sistema (seja porque atingiu a temperatura ambiente ou teve uma fonte de calor removido).
2.A temperatura de ebulição de um líquido depende da pressão ― altas pressões produzirão altas temperaturas de ebulição e baixas pressões produzirão baixas temperaturas de ebulição. Uma experiência comum simples é colocar um copo de água em uma câmara de vácuo e, em seguida, reduzir a pressão na câmara até que a água ferva. Ao reduzir a pressão, a água ferve mesmo à temperatura ambiente. Isto funciona em ambos os sentidos ― se a pressão é aumentada além das pressões atmosféricas normais, a ebulição da água quente pode ser suprimida muito além das temperaturas normais. O sistema de resfriamento de um motor de combustão interna moderno é um exemplo do mundo real.
3.Quando um líquido ferve, ele se transforma em gás ou vapor. O gás ou vapor resultante ocupa muito mais espaço do que o líquido.
Tipicamente, uma BLEVE começa com um recipiente de líquido que é mantido acima da sua temperatura de ebulição normal à pressão atmosférica. Muitas substâncias normalmente armazenadas como líquidos, tais como CO2, propano, butano e outros gases industriais similares têm temperaturas de ebulição, à pressão atmosférica, muito abaixo da temperatura ambiente. No caso da água, um BLEVE pode ocorrer se uma câmara pressurizada de água é aquecida muito além do padrão 100 ° C. Esse recipiente, porque a água fervente o pressuriza, é capaz de reter água líquida a temperaturas muito elevadas.
Se o recipiente pressurizado, contendo líquido a alta temperatura (que pode ser temperatura ambiente, dependendo da substância) rompe, a pressão que evita que o líquido ferva é perdida. Se a ruptura for catastrófica, onde o vaso é imediatamente incapaz de exercer qualquer pressão, então, de repente, existe uma grande massa de líquido que está em temperatura muito alta e pressão muito baixa. Isso faz com que uma porção do líquido ferva "instantaneamente", o que por sua vez provoca uma expansão extremamente rápida. Dependendo das temperaturas, pressões e da substância envolvida, essa expansão pode ser tão rápida que pode ser classificada como uma explosão, totalmente capaz de infligir danos graves em seu entorno.
Exemplo da água
Por exemplo, um tanque de água líquida pressurizada mantida a 204,4 ° C pode ser pressurizado a 1,7 MPa (250 psi) acima da pressão atmosférica ("calibre"). Se o tanque contendo a água fosse romper, haveria por um breve momento um volume de água líquida que estaria:
- na pressão atmosférica e
- a temperatura de 204,4 ° C.
Na pressão atmosférica o ponto de ebulição da água é 100 ° C ― água líquida à pressão atmosférica não existe a temperaturas superiores a 100 ° C. Naquele momento, a água ferveria e se transformaria em vapor explosivamente, e a água líquida a 204.4 ° C transformada em vapor ocuparia significativamente mais volume (~ 22 vezes) do que faz como líquido, causando uma explosão de vapor. Essas explosões podem acontecer quando a água superaquecida de uma máquina a vapor escapa através de uma fenda em uma caldeira, causando uma explosão da caldeira.
BLEVEs sem reações químicas
Uma BLEVE não precisa ser uma explosão química ― nem precisa ser um incêndio ― no entanto se uma substância inflamável está sujeita a uma BLEVE também pode ser sujeita a um aquecimento intenso, quer de uma fonte externa de calor que pode ter causado o rompimento do vaso em primeiro lugar ou a partir de uma fonte interna de aquecimento localizado, tal como o “atrito de pele”, um atrito de superfície causado por atrito fluido, ou arraste. Este aquecimento pode provocar a inflamação de uma substância inflamável, adicionando uma explosão secundária causada pela BLEVE primária. Enquanto os efeitos de explosão de qualquer BLEVE pode ser devastador, uma substância inflamável, como propano pode adicionar significativamente perigo.
Um esquema simplificado da evolução de uma BLEVE.
Embora o termo BLEVE seja mais frequentemente usado para descrever os resultados de uma ruptura de um recipiente de líquido inflamável devido a incêndio, uma BLEVE pode ocorrer mesmo com uma substância não inflamável, como água,[2] nitrogênio líquido,[3] hélio líquido ou outros refrigerantes ou criogénicos e, portanto, não é normalmente considerado um tipo de explosão química.
Incêndios
BLEVEs podem ser causada por um fogo externo perto do recipiente de armazenamento causando aquecimento do conteúdo e acúmulo de pressão. Enquanto os tanques são muitas vezes concebidos para suportar uma grande pressão, aquecimento constante pode causar enfraquecimento do metal e eventualmente falhas. Se o tanque estiver sendo aquecido em uma área onde não há líquido, ele pode romper mais rápido sem o líquido para absorver o calor e dissipá-lo por convecção. Os recipientes de gás são normalmente equipados com válvulas de alívio que liberam o excesso de pressão, mas o tanque ainda pode falhar se a pressão não for liberada rapidamente.[1] As válvulas de alívio são dimensionadas para liberar a pressão rapidamente o suficiente para evitar que a pressão aumente para além da força do recipiente, mas não tão rapidamente quanto a ser a causa de uma explosão. Uma válvula de alívio de tamanho apropriado permitirá que o líquido no interior ferva lentamente, mantendo uma pressão constante no recipiente até todo o líquido ter fervido e o recipiente esvaziar.
Se a substância em questão for inflamável, é provável que a nuvem resultante da substância se incendie após a BLEVE ter ocorrido, formando uma bola de fogo e possivelmente uma explosão de combustível-ar, também denominada explosão de nuvem de vapor (VCE, vapor cloud explosion). Se os materiais forem tóxicos, uma grande área será contaminada.[4]
Se a substância em questão for inflamável, é provável que a nuvem resultante da substância se incendie após a BLEVE ter ocorrido, formando uma bola de fogo e possivelmente uma explosão de combustível-ar, também denominada explosão de nuvem de vapor (VCE, vapor cloud explosion). Se os materiais forem tóxicos, uma grande área será contaminada.[4]
Incidentes notórios
O termo "BLEVE" foi cunhado por três pesquisadores da Factory Mutual, na análise de um acidente ocorrido em 1957 envolvendo um vaso reator químico. Anthony Santos foi um dos Engenheiros Químicos que trabalham na FM que cunhou o termo.[5]
Em agosto de 1959, o Departamento de Bombeiros de Kansas City sofreu sua 2ª maior perda de vida na linha de serviço, quando um tanque de gasolina de 95 mil litros explodiu durante um incêndio em Southwest Boulevard matando cinco bombeiros. Esta foi a primeira vez que o termo BLEVE foi usado para descrever um tanque de combustível em chamas.
Incidentes posteriores incluíram o incêndio no armazém de whisky da rua Cheapside em Glasgow, Escócia, em 1960; Feyzin, França, em 1966; Crescent City, Illinois, em 1970; Kingman, Arizona em 1973; Uma ruptura de tanque de nitrogênio líquido na Air Products and Chemicals e Mobay Chemical Company em New Martinsville;[6] West Virginia em 31 de janeiro de 1978;[1] Texas City, Texas, em 1978; Desastre de Los Alfaques, Espanha em 1978; Murdock, Illinois em 1983; San Juan Ixhuatepec, Cidade do México em 1984; e Toronto, Ontário em 2008.
Referências
1.Kletz, Trevor (March 1990). Critical Aspects of Safety and Loss Prevention. London: Butterworth–Heinemann. pp. 43–45.ISBN 0-408-04429-2.
2."Temperature Pressure Relief Valves on Water Heaters: test, inspect, replace, repair guide". Inspect-ny.com.
Ligações externas
BLEVE Edson Haddad, químico, Gerente da Divisão de Gerenciamento de Riscos da CETESB -
BLEVE (Boiling Liquid Expanding Vapor Explosion) Demonstration - How it Happens Training Video - www.youtube.com
Faisal I Khan, S.A Abbasi; Major accidents in process industries and an analysis of causes and consequences; Journal of Loss Prevention in the Process Industries, Volume 12, Issue 5, September 1999, Pages 361–378. - www.sciencedirect.com
Quando os problemas se somam
Agora, tratemos de um fenômeno relacionado à BLEVE e à ebulição explosiva e que ocorre em tancagens de líquidos combustíveis, apolares (não solúveis em água, como a imensa maior parte dos hidrocarbonetos e óleos vegetais), mesmo sem o rompimento dos vasos, e até em reservatórios literalmente abertos à atmosfera, como os grandes tanques de armazenamento de óleo bruto (petróleo), e deve-se muitas vezes à aplicação inadequada de água no combate a incêndios em reservatórios de combustíveis apolares, quando pode haver a formação de uma "bacia" de água sob o fluido em combustão, e ao se atingir determinados equilíbrios de forças, iniciar-se um jorro vaporizante (formação de spray), “atomização”, que piora terrivelmente o incêndio.
Um exemplo, em vídeo:
Nasty Big Oil Tank Explosion - YouTube.com
Este fenômeno é chamado no meio de Boilover ou “explosão por vaporização”.
Uma citação
Boilover é um fenômeno tão perigoso quanto o BLEVE pois pode causar múltiplas vítimas, principalmente pessoas que fazem parte do grupo de combate a incêndio. O Boilover ocorre principalmente em tanques de estocagem de produto que possuem água misturada e, que devido a sua maior densidade, permanece no fundo do tanque. Exemplos são tanques de armazenagem de óleo cru. Quando o líquido inflamável, ou combustível, pega fogo e consegue aquecer a água no fundo do tanque, a água superaquecida pode vaporizar repentinamente e expulsar o líquido em chamas, podendo formar uma grande bola de fogo e, ao mesmo tempo, criar uma enorme poça de líquido em chamas que pode atingir várias pessoas nas imediações. Todo cuidado é pouco em incêndio desse tipo: se estiver fazendo um combate com água e houver vaporização da água no fundo do tanque que estiver escorrendo no costado, é o momento das pessoas de afastarem imediatamente porque está prestes a ocorrer o Boilover.
Elisio Carvalho - Você sabe o que é Boilover? - maio 12, 2016 - www.ecsconsultorias.com.br
Esquematicamente:
Quando temos a fase 1, a coluna de combustível (estando em chamas ou não) é muito maior que a pressão de vapor da água no fundo do recipiente. Com a continuidade do incêndio ou a simples transferência de calor do combustível para a água ― aqui representados por fases em alteração de volume, pois supomos que a combustão está se dando num incêndio e a aplicação de água continua ― a coluna de combustível diminui, a troca térmica com a água persiste, até o momento que a água entra em violenta ebulição e produz a vaporização, aumentando tremendamente a superfície de contato do combustível com a atmosfera.
Estes casos permitem também didática sobre geração de energia em combustões, pois a escala (até milhares de toneladas) aproximam-se em energia de explosões nucleares, apenas mudando, claro, a potência o espectro em radiações.
Detalhando, num "maracanã", gíria na indústria de petróleo brasileira para os grandes tanques de óleo bruto e até de produto acabado como o "fuel oil" (diesel pesado), uma coluna de 6 metros pode ser formada, com densidade 0,8, digamos. Estabelece-se uma "pressão estanque" da ebulição, que causado o colapso, promove a subida de uma coluna de vapor, digamos uma expansão "trivial" potencial de 1500 vezes (dados de combate á incêndio, adotados como uma boa referência, num duto pelo líquido apolar, com sobreaquecimento, como num duto de trocador de calor).
Existe um caso notório na Venezuela, nos anos 1960, em que a emissão de radiação chegou a amolecer o acrílico da fuselagem do helicóptero que estava filmando o incêndio.
“Venezuela tem registro para a maioria das pessoas mortas em um boilover de petróleo bruto
Nota do Editor: Em 19 de dezembro de 1982, uma grande multidão de trabalhadores de usinas de energia e residentes locais em Tacoa, Venezuela, se reuniram para assistir a um tanque de armazenamento de petróleo bruto queimando. Quase oito horas haviam passado desde que o tanque primeiro pegou fogo. Se os observadores compreendessem melhor um fenômeno devastador conhecido como boilover, a erupção de vapor e óleo quente que se seguiu não teria reivindicado mais de 150 vidas. Os relatos em primeira mão dos que testemunharam o evento enfatizam o óbvio - o potencial de boilover deve ser tratado com respeito.”
Venezuela holds record for most people killed in a crude oil boilover - www.fireworld.com
(página aparentemente extinta)
(página aparentemente extinta)
Em vídeo: Boilover Tacoa Venezuela- UNEFA.wmv - YouTube.com
Literatura adicional
Michiel A. J. van Limbeek, Henri Lhuissier, Andrea Prosperetti, Chao Sun, and Detlef Lohse; Explosive boiling?; Phys. Fluids 25, 091102 (2013); doi: 10.1063/1.4820014 - stilton.tnw.utwente.nl - Nos nossos arquivos: [ Limbeek - Explosive boiling ]
Yusheng Dou, Leonid V. Zhigilei, Nicholas Winograd,, and Barbara J. Garrison;;Explosive Boiling of Water Films Adjacent to Heated Surfaces: A Microscopic Description - www.psu.edu
M Shusser, D Weihs; Explosive boiling of a liquid droplet; International Journal of Multiphase Flow
Volume 25, Issue 8, December 1999, Pages 1561–1573. - www.sciencedirect.com
Fabiano B, Kersten RJ, Opschoor G, Pastorino R.; Theoretical and experimental investigation into the explosive boiling potential of thermally stratified liquid-liquid systems.;J Hazard Mater. 2002 Jul 1;93(1):107-21. - www.ncbi.nlm.nih.gov
Resumo
A ocorrência de uma transição rápida de fase, ou a chamada "ebulição explosiva", quando um líquido volátil frio entra em contato com uma superfície quente ou líquido quente é um perigo potencial na indústria. Este estudo incidiu sobre o potencial explosivo de ebulição de sistemas líquido-líquido termicamente estratificados que resultam de uma reação em cadeia. Os ensaios experimentais foram realizados tanto em um sistema não-reagente como num sistema em reação. Os resultados experimentais mostraram que, sob as condições estudadas, a fase fria foi sobreaquecida mas não evapora explosivamente, dado que os limites de sobreaquecimento da fase não foram alcançadas. A resposta da fase fria parecia ser completamente controlada pela temperatura da interface entre a fase quente e a fria. Em geral, com base na ordem de grandeza de diferença de temperatura que resultam de uma reação fugitiva num sistema multi-fásica e o fato de que o sistema é pressurizado pela sua própria pressão de vapor, a ocorrência de ebulição explosivo em condições fugitivos parece pouco provável para estes tipo de sistemas."
A ocorrência de uma transição rápida de fase, ou a chamada "ebulição explosiva", quando um líquido volátil frio entra em contato com uma superfície quente ou líquido quente é um perigo potencial na indústria. Este estudo incidiu sobre o potencial explosivo de ebulição de sistemas líquido-líquido termicamente estratificados que resultam de uma reação em cadeia. Os ensaios experimentais foram realizados tanto em um sistema não-reagente como num sistema em reação. Os resultados experimentais mostraram que, sob as condições estudadas, a fase fria foi sobreaquecida mas não evapora explosivamente, dado que os limites de sobreaquecimento da fase não foram alcançadas. A resposta da fase fria parecia ser completamente controlada pela temperatura da interface entre a fase quente e a fria. Em geral, com base na ordem de grandeza de diferença de temperatura que resultam de uma reação fugitiva num sistema multi-fásica e o fato de que o sistema é pressurizado pela sua própria pressão de vapor, a ocorrência de ebulição explosivo em condições fugitivos parece pouco provável para estes tipo de sistemas."
Destaco: "sistema é pressurizado pela sua própria pressão de vapor"
Para grandes escalas, a "coluna" do fluido superior, como num tanque de óleo, é importantíssimo fator.
W Porteous, M Blander; Limits of superheat and explosive boiling of light hydrocarbons, halocarbons, and hydrocarbon mixtures; AIChE Journal, Volume 21, Issue 3, May 1975, Pages 560–566 - DOI: 10.1002/aic.690210319 - onlinelibrary.wiley.com
Resumo
Os limites de sobreaquecimento de treze hidrocarbonetos leves e quatro halocarbonetos leves foram medidos experimentalmente a uma atmosfera utilizando uma coluna de sobreaquecimento. Embora houvesse alguma variação no número de graus a que um composto poderia ser superaquecido antes da fervura explosiva, em todos os casos os limites reduzidos TL / Tc estavam próximos de 0,88. Os limites de superaquecimento de três sistemas de hidrocarbonetos binários e várias misturas ternárias foram próximos das médias de fração molar dos limites dos componentes puros. Os resultados de ambos os componentes puros e misturas paralelos as previsões de Beegle (1973), com base na teoria da estabilidade termodinâmica. Limites de componentes puros concordaram estreitamente com os limites previstos a partir da teoria da nucleação homogênea.
C. T. Avedisian and I. Glassman; High Pressure Homogeneous Nucleation of Bubbles within Superheated Binary Liquid Mixtures; J. Heat Transfer 103(2), 272-280 (May 01, 1981) (9 pages)doi:10.1115/1.3244453 - heattransfer.asmedigitalcollection.asme.org




Nenhum comentário:
Postar um comentário